DIABETES NEWS No.175
|
 | |||||||
第57回 日本糖尿病学会関東甲信越地方会 参加報告
東京女子医科大学 糖尿病・代謝内科学講座 教授・講座主任
馬場園哲也
馬場園哲也
◆1型糖尿病患者におけるSGLT2阻害薬によるケトアシドーシス
最近SGLT2阻害薬を開始後ケトアシドーシスをきたした2型糖尿病の報告が増加しています。これまでSGLT2阻害薬の効能・効果は2型糖尿病に限定されていましたが、最近同剤の一部が1型糖尿病にも使用可能となりました。今回の地方会では、複数の施設から1型糖尿病に対するSGLT2阻害薬の有効性と安全性を検討した結果が発表されました。そのなかで、開始後ケトアシドーシスを発症した1型糖尿病症例も報告されました。まだ個々の症例報告に留まっており、2型糖尿病との頻度の比較や誘因などは不明ですが、日本糖尿病学会の「SGLT2阻害薬の適正使用に関するRecommendation」を参考にして、1型糖尿病ではより慎重な観察が必要です。
◆SGLT2阻害薬による周術期の正常血糖糖尿病ケトアシドーシス
2型糖尿病におけるSGLT2阻害薬投与後のケトアシドーシスの多くは、著明な高血糖が見られない、いわゆる正常血糖糖尿病ケトアシドーシスを呈することが知られています。当科からの症例報告も、最近日本糖尿病学会の機関誌に掲載されました(加藤勇人ほか:SGLT2阻害薬および低炭水化物食開始後に正常血糖糖尿病ケトアシドーシスを起こした2型糖尿病の1例.糖尿病 63(1): 26-34, 2020)。正常血糖糖尿病ケトアシドーシスの誘因として、炭水化物の摂取不足が重要です。今回の地方会では、周術期にSGLT2阻害薬による正常血糖糖尿病ケトアシドーシスを引き起こした2型糖尿病症例が報告されました。著明な高血糖がなかったことから、古典的な概念である外科的糖尿病によるケトアシドーシスは否定されました。全身麻酔下の手術前は絶飲食が指示されるため、通常SGLT2阻害薬などの糖尿病薬は術前に休薬されますが、この患者さんでは休薬期間が短かった可能性があります。良い教訓にしたいと思います。
◆1型糖尿病を発症した歌舞伎症候群
当科からの症例報告です。歌舞伎症候群とは、1981年に新川らによって見出された先天異常症候群で、目が切れ長で下眼瞼外側1/3が外反していることから歌舞伎役者の化粧(隈取)を連想させる顔貌が特徴的です。7歳時に本症候群と診断され、先天性心疾患があったため以後当院の循環器小児科で経過観察されていましたが、40歳時に1型糖尿病を発症しました。当初偶然の合併と考えておりましたが、文献を検索すると、同様の症例がこれまでに3例報告されていました。歌舞伎症候群が極めて稀な疾患であり、両者に因果関係があるか偶発的な合併かは不明ですが、今後症例の蓄積が必要と考え、報告しました。br />
|
|
低炭水化物食って、大丈夫?
東京女子医科大学
糖尿病センター
内科 教授
中神朋子
糖尿病センター
内科 教授
中神朋子
◆低炭水化物食について
低炭水化物食の始まりは、ロバート・アトキンス医学博士が提唱した「アトキンス・ダイエット」と言われており、低炭水化物食を中心とした食事療法が、減量の方法として急速に広まりました。糖尿病は食事と密接な関係があり、低炭水化物食に関する議論が活発に行われていたため2008年に発表されたDIRECT研究(N Engl J Med)の結果には注目が集まりました。DIRECT研究はイスラエルの研究所勤務の40~65歳でBMI27kg/m2以上、2型糖尿病または冠動脈疾患を有する男女322名において①低脂肪食(総摂取エネルギー量を制限、その30%を脂肪、10%を飽和脂肪酸から摂取。1日の総コレステロール摂取量300mg/dL以下とする)、②地中海食(総摂取エネルギー量を制限、その35%未満を脂肪(主はオリーブオイル)、少量の豆類と野菜を多く摂取し赤身肉を控える)、③低炭水化物食(総摂取エネルギー量、タンパク質、脂肪の摂取量に制限なし。炭水化物を40%に制限。最初の2カ月は炭水化物量20g/日まで抑制し体重減維持できる範囲で最大120g/日まで段階的に増やす)の食事療法を2年間行う介入試験です。この3種類の食事療法群においてベースラインから24か月後の体重変化量を1次エンドポイントとして比較しました。結果は、いずれの群においても1~6か月で体重は大きく低下し、その後部分的な増加の後で一定値に落ち着く傾向がありました。しかし、低脂肪食群(-2.9㎏)に比べて、地中海食群(-4.4㎏)と低炭水化物食群(-4.7㎏)で有意な体重減少効果がみられ、低炭水化物食に対する議論が再び巻き起こる、大きなインパクトを与えました。しかし、その発表から10年以上経った今も、各国、各学会において統一の見解が出ておらず、低炭水化物食に関する議論に終止符は打たれていません。◆DIRECT研究から考える
最新の「糖尿病診療ガイドライン2019 第3章食事療法(Q3-5)」において、"炭水化物の摂取量は糖尿病の管理にどう影響するか?"という点について述べられていますが、「炭水化物摂取量と糖尿病の発症リスク、糖尿病の管理状態との関連性は確認されていない。」と記載されており、学会としては低炭水化物食を推奨する立場を取っていません。本ガイドラインにおいてはDIRECT研究の結果で考慮すべき点が述べられています。炭水化物制限群でも総エネルギー摂取量が他の群と同様に低下しており、つまり、体重減少効果が炭水化物食の効果のみと解釈できない点を指摘しています。日本人を対象とした試験(Intern Med 2014, Clin Nutr 2017, PLos ONE 2017)やメタ解析の結果(PLos ONE 2014)においても低炭水化物食による明確な有用性を示すことができていません。また、炭水化物を制限した場合、自然と各栄養素のバランスが崩れることになります。例えば低炭水化物食により、たんぱく質が増えることが懸念され、腎症への影響も念頭におく必要が出てきます。このように、低炭水化物食を取り入れる際に、患者個々に合わせてバランスの良い栄養配分を設定することは、食事療法において欠かせないのではないでしょうか。◆おわりに
食事療法においては文化や地域性、ライフスタイルの多様な変化など、様々な影響を考慮する必要があります。また、他国に比べて急速に高齢化が進んでいる本邦の現状や、糖尿病患者では腎症などの併存疾患の有無による栄養配分などを考慮した評価を行う必要もあり、低炭水化物食の是非を問うだけでは不十分といえるでしょう。個別化を考慮した、本邦の糖尿病患者を対象とした長期観察に基づくエビデンスが待たれます。|
|
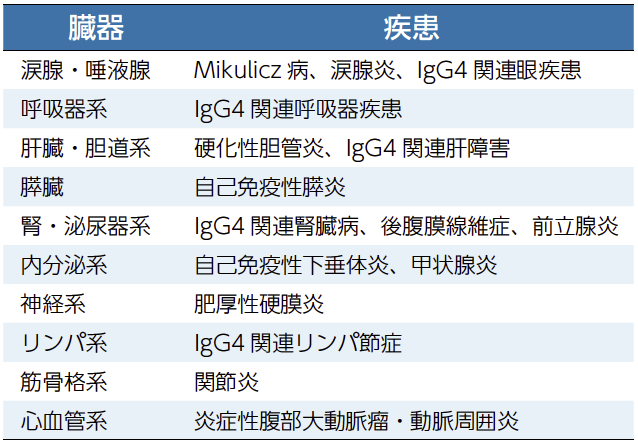
IgG4関連疾患と糖尿病
東京女子医科大学
八千代医療センター
糖尿病内分泌代謝内科
医療練士研修生
須田博之
東京女子医科大学
八千代医療センター
糖尿病内分泌代謝内科
特任教授
橋本尚武
八千代医療センター
糖尿病内分泌代謝内科
医療練士研修生
須田博之
東京女子医科大学
八千代医療センター
糖尿病内分泌代謝内科
特任教授
橋本尚武
◆AIPと糖尿病
AIPは1995年に本学消化器病センターの吉田、士岐らが提唱した新しい疾患概念で(Dig Dis Sci 1995;40:1561-68)、膵腫大と膵管のびまん性狭細がみられ、病理組織学的には膵導管周囲への著明なリンパ球と形質細胞の浸潤、高度の繊維化が特徴的です。膵外分泌や内分泌機能障害をきたし、2002年の1年間に受療したAIP患者の66.5%に糖尿病の合併を認めたと報告されています(Pancreas 2006;32 244-248)。◆AIP合併糖尿病の臨床病型
AIP合併糖尿病の臨床病型は発症時期に応じ、①AIP発症前より糖尿病を有する症例、②AIP発症と同時期に糖尿病を発症する症例、③AIPに対するステロイド治療後に糖尿病を発症する症例、の3群に分類されます。2006年のAIP全国実態調査によりますと、①34.3%、②56.9%、③8.8%であり、AIPと糖尿病を同時に発症した症例ではAIP発症前から糖尿病を有していた症例より有意に若年であるという結果でした(J Dig Dis 2011;12:210-216)。◆AIP合併糖尿病の治療法
実態調査によりますと、AIP合併糖尿病では約5割がインスリン治療、3割が食事療法のみ、2割が経口血糖降下薬を使用していました。インスリン治療が占める割合は、①57%、②48%、③45%であり、AIP発症前から糖尿病を有していた症例で最も高い傾向にありました。これらの結果から、膵組織への著明な炎症細胞浸潤と線維化の進行は急速な膵β細胞の機能障害を引き起こし、さらにはステロイド治療による副作用で血糖コントロールが困難となるという側面もあります。
一方AIPに対するステロイド治療により、膵炎が沈静化し、同時にインスリン治療が不要となる症例も存在します。Nishinoらはステロイド治療後にAIP合併糖尿病患者の25%で耐糖能が改善したと報告しました(Intern Med 2006;45:497-501)。
◆AIP合併糖尿病の病態
AIPでは高密度にIgG4陽性形質細胞が存在していますが、これらは膵島にはさほど浸潤していません。膵内分泌機能の低下がどのような機序で生じるか、またステロイド治療により、どのような機序で内因性インスリン分泌が速やかに改善するのかなど、AIP合併糖尿病には不明な点も多いのが現状です。2018年に、AIPの自己抗原が膵臓の細胞外マトリックスを形成するラミニン511という蛋白質であることが発見されました(Sci Transl Med 2018;10:eaag 0997)。今後の原因の解明が期待されます。